SARS-CoV-2(サーズコロナウイルス2) 新型コロナウイルスを理解する
 PD https://phil.cdc.gov/Details.aspx?pid=23312
PD https://phil.cdc.gov/Details.aspx?pid=23312
This image is a work of the Centers for Disease Control and Prevention, part of the United States Department of Health and Human Services.
序
東京の街中から人が消えるという、我々が経験したことのない世界が現実に生まれている。 世界の感染者数は、2020.05.22.時点で500万人を超え、死者は35万人に迫っている。 わずか4ヶ月程度で、このような別世界をつくりだした新型コロナウィルスとは、一体何者であろうか?
新型コロナウイルス感染症(COVIT19)に関しては、生命科学・分子生物学的アプローチのほかに、公衆衛生上の観点や、臨床的観点、
あるいは数理モデルを用いた統計学的・社会学的観点など、
様々な科学分野の総力を結集して、このウイルスの克服に向けた研究が進められている。
しかしそもそも、
① 新型コロナウイルスの正体は何なのか(ウイルスの生い立ちや構造)
② なぜこれほどの感染力をもち、急速な病状悪化と高い死亡率をもたらすのか(細胞侵入メカニズムの特異性)
③ そして人類がコロナウイルスに対抗するにはどのような方法論があるのか(創薬など)
という、根本的な疑問があるわけである。
このうち、①はほぼ解明されている。②も多くは解明されつつあるが未解明部分も依然残っている。
③はこれからのイノベーションをさらに待たねばならない。
本稿は、主にこの①〜②について、現時点までの理解を整理する試みだ。 本稿の著者は専門家ではない。有料論文の購読もしていない。従ってWebページ上の既出の論文や、分子生物学関係の著作などを基にして行う。画像等もライセンスフリーのものに限って用いる。 ばらばらにある新型ウイルスの情報を専門領域も含めて統合して、どこまでわかりやすく整理できるかトライしてみる。
1.SARS-CoV-2のウイルス分類上の位置づけ
今回の新型コロナウイルスは、SARS-CoV-2と言われていることからもわかるように、 今世紀はじめに世界中に多くの患者が出たサーズコロナウイルスとはいわば姉妹関係だ。 ヒトでは、風邪のウイルスなど7種類のコロナウイルスが知られるようになった。 今回の新型コロナウイルスもその一つだ。 このような位置づけは、中国武漢での流行確認から間をおかず、直ちに行われた遺伝子解析により明らかとなった。 解析に要した日数はわずか一週間である。 サーズコロナウイルスの遺伝子構造が明らかになるまでは、半年以上を要したと聞く。 それもそのはず、SARSの流行は2003年のことである。 ヒトの全ゲノム解析が完了したのが、この2003年だ。 これには先進各国の研究機関による国際コンソーシアムとアメリカの民間企業が競合して行われたが、 数年を要したと記憶している。 今日では、約32億5400万塩基対あるヒト一人分のゲノム解析に、わずか1日しか要さない。 驚くべき技術進展と言わなければならない。 それでも、今回の新型ウイルスのことは、わからないことがまだ多くある。
世界で検出された新型コロナウイルスを遺伝子型で分類すると
さらにABCの3タイプに分類されると発表されたばかりだ。[4月28日付 米PNAS誌(初稿4月8日)]
中国など東アジアに多い型や、欧米で多く見つかっている型など「地域株」があるということだ。
ウイルスはヒトなどの細胞内で増殖しながら絶えず変異している。
世界各国での登録済ゲノム(4511人分)と、日本での陽性検体ゲノム(562人分)を統合し塩基変異を抽出、
ウイルス株の親⼦関係を解析したところ、2019年末から2020年4月までの約4ヶ月間でゲノム全域に少なくとも 9 塩基ほどの変異がランダムに発⽣しているとのことだ。[4月27日付 国⽴感染症研究所 病原体ゲノム解析研究センター]
この疫学調査によれば、日本は第一波の武漢株(ダイヤモンド・プリンセス号株も含め)の抑え込みに成功したものの、
その後の欧州からの帰国者等を起点とする第二波クラスターを抑え込むことができなかった。
3月以降、感染リンク不明とされた孤発例が多数検出されるようになったことからも、
ヨーロッパ株を起点とした症例が国内に拡散したことが強く⽰唆されている(同疫学調査)。
こうした見解もすべて、世界と⽇本のゲノム情報を統合して塩基変異を抽出し、
感染クラスターの遺伝子特徴を明らかにして、ウイルス株の親⼦関係を一つ一つ解明していってわかったことだ。
ウイルスは細菌と異なりタンパク質やATPの合成ができないので、一般に代謝機能もなく自ら自己複製できないのは周知のとおりだ。
このために宿主に感染し、宿主細胞のタンパク質合成機構や代謝エネルギーを利用して増えていく。
ウイルスにも様々な種類があり、含まれる核酸の型などにより詳細に分類されている。
今回の新型コロナウイルスはRNA型ウイルスだ。ウイルスの遺伝子がDNAではなくRNAなのである(一本鎖プラス鎖RNA)。
ここで「一本鎖」とはもちろんヒトゲノムのように二本鎖ではないということである。
「プラス鎖」とは、ウイルスのRNAが、そのままmRNAとして機能するということだ。
したがって宿主細胞内で<5'→3'>方向に読み込まれ、直接にタンパク質を翻訳する。
プラスがあればマイナスもある。
インフルエンザウイルスなどは「マイナス鎖」型であり、感染後に相補的なプラス鎖RNAを経てタンパク質の翻訳が行われる。
ちなみに、新型コロナウイルスと同じ一本鎖プラス鎖RNAのなかでも、逆転写酵素を持つものを<レトロウイルス>と呼び、HIV(いわゆるAIDSウイルス)などがよく知られている。レトロウイルスは宿主細胞に侵入後、逆転写酵素によりDNAを作成しこれが核に入って新たなウイルスの複製を行うのであり、今回の新型ウイルスの増殖方法とは異なっている。
[第4群] ー [ニドウイルス目] ー [コロナウイルス科] ー [コロナウイルス亜科] ー [ベータコロナウイルス属] ー [SARSコロナウイルス-2]
役所の組織図のごときだが、これが国際ウイルス分類委員会(ICTV)による分類体系上の位置づけとなる。 [コロナウイルス亜科]では、現在27種類ほどが知られており、このうちヒトに感染するものは、SARSやMARSなど7種類だ。
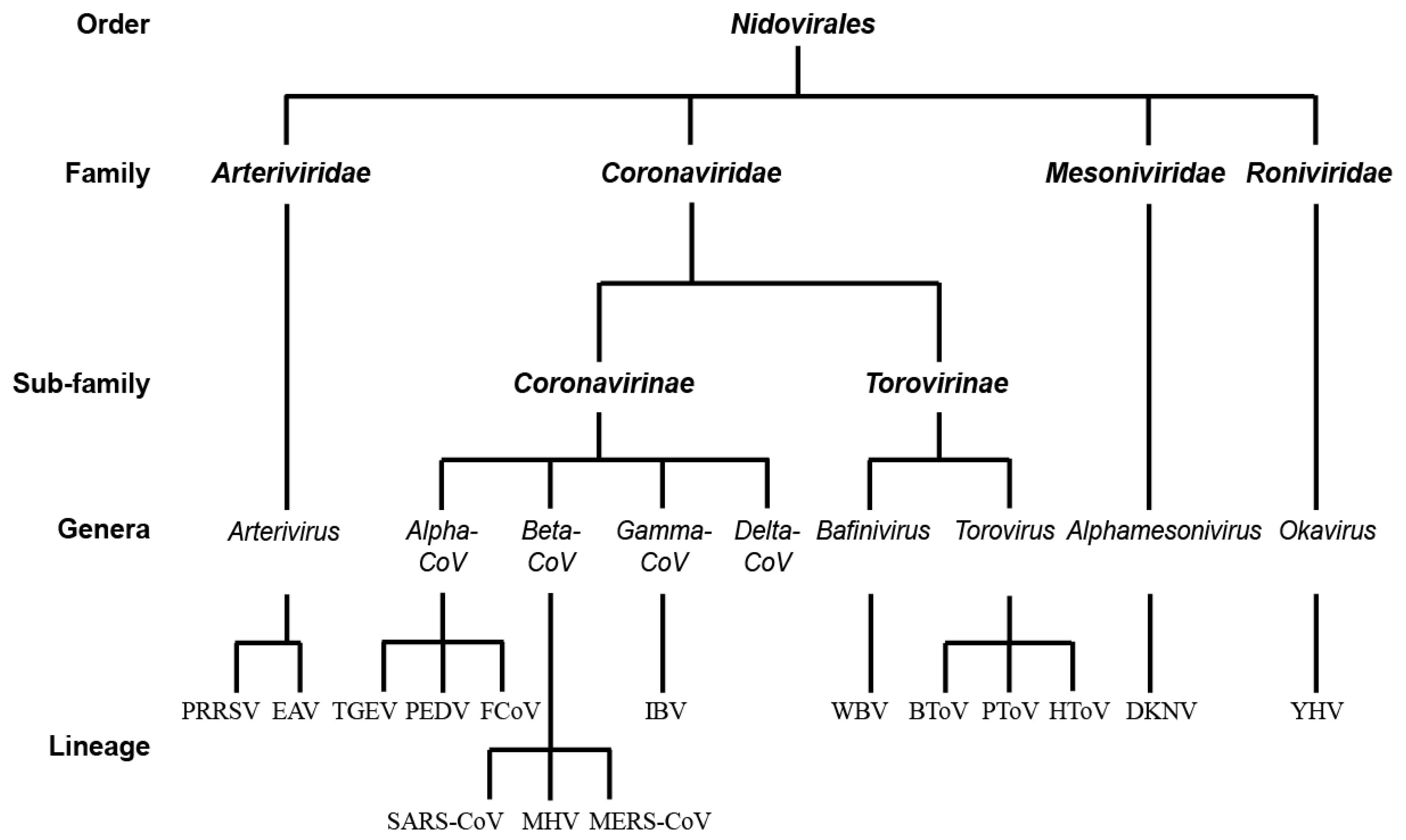
CC BY Taxonomy tree of the order Nidovirales.webp
※図の最下部に「SARS-CoV」が表記されている。今回の新型ウイルス「SARS-CoV-2」は、これと横並びになる。
新型コロナウイルス (SARS-CoV-2)は 、2003年のSARSコロナウイルス (SARS-CoV) と同じ種(姉妹系統)と見なされている。
以降は、この新型コロナウイルスをICTVの命名に基づき【SARS-CoV-2】と記述する。「-CoV-」は《CoronaVirus》だ。《Virus》はヴィールス。日本では現在「ウイルス」と読ませているが、かつては「ビールス」と、言語に近い発音で読んでいた。一方「SARS:サーズ」は【SARS-CoV】とし、特に区別を必要とする場合、便宜上【2003-SARS-CoV】とした。
SARS-CoV-2のタンパク質やRNAを他のコロナウイルス類と比較すると、同じベータコロナウイルス属のMARS-CoVとはタンパク質で3割以下、RNAで5割と低い相同性だが、SARS-CoVとは8〜9割以上の相同性があるという。
だが、SARS-CoVの直接の子孫ではない。
元々コウモリなどの野生動物が保因していたものが、ヒトへの感染能力を獲得したと考えられている。
2020年3月には希少哺乳類のマレーセンザンコウから、ゲノムが85〜92%類似するコロナウイルスが発見されており、
コウモリ⇒センザンコウ⇒ヒト、というルートなのかもしれない。
2.SARS-CoV-2の構造

PD https://www.flickr.com/photos/niaid/49534865371/ NIAID
1. 概要
新型コロナウイルス【SARS-CoV-2】の粒子径は50〜200 ナノメートル(nm)ほどの大きさだ。
1nmは、1mmの10万分の1、1mm=1000µm(マイクロメートル)、1µm=1000nmという関係だ。
サイズ感の話をすると、ウイルスの大きさが上記の通り、まあ大体100nmとして、細菌は1µm以上、天気予報でよく聞くpm2.5はまさに2.5µm、スギ花粉が30µmだ。ちなみに太陽の直径は地球の約109倍、スギ花粉はウイルスの約300倍だから、地球から見た太陽よりも3倍も大きい存在だ。いかにウイルスが小さいかがわかるだろう。
ウイルスは光学顕微鏡では見ることはできない。電子顕微鏡が普及しだしたのが20世紀中盤だから、それ以前の研究者にはウイルスの存在はわからなかった。
SARS-CoV-2の完全ゲノム配列は、上海公共衛生臨床センターらによって解読され、2020年1月14日に国際機関のデータベースに正式公開されている。
そのゲノムサイズは29,903 base(約3万塩基対ということ)であり、RNAウイルスの中では最も長い部類という。
SARS-CoV-2は、既知の他のコロナウイルスと同様に以下の構成要素からなっている。
これら新型ウイルスに関連するタンパク質は次々に解明されており、その詳しい構造はPDB(プロテインデータバンク)に登録されていく。
①S(スパイク)タンパク質
②N(ヌクレオカプシド)タンパク質
③M(膜)タンパク質
④エンベローブ
⑤E(エンベロープ)タンパク質
⑥RNA(ウイルス遺伝子、一本鎖プラス鎖リボ核酸)
①S:スパイクタンパク質(スパイク糖蛋白、Sタンパクとも)(Spike glycoprotein)
Sタンパクは、粒子状のウイルス表面の膜に文字通りスパイク様に突き刺さった形をとり、王冠状にウイルスを取り巻いていることから、コロナの名の由来となっている。タンパク質と糖鎖からなっていて、宿主細胞への侵入に重要な役割を果たす。
②N:ヌクレオカプシドタンパク質(nucleocapsid Protein) ヌクレオカプシドタンパク質は、カプシドがウイルスRNAゲノムと結合したもので、これをリボヌクレオカプシド(リボ核タンパク質(RNP)複合体)、または単に「ヌクレオカプシド」と言っている。パッケージ化によりゲノムである核酸を核酸分解酵素などから保護する。このパッケージングは、ウイルスのセルフ-アセンブリと複製の基礎的部分である。なおエンベローブを持たないウイルス種では、このNタンパクが最外皮となるわけだ。
③M:膜タンパク質(Membrane Protein) ウイルスエンベロープの構成パーツで、スパイクタンパク質の間に局在しており、ウイルスの出芽プロセスの主要な駆動力となっている。他のタンパク質との相互作用により、ウイルスの形態形成とアセンブリで中心的な役割を果たす。
④エンベローブ(Envelove)
エンベロープは通常、宿主細胞膜(リン脂質とタンパク質)に由来する膜であり、ウイルス粒子(ビリオン)の最も外側に位置している。ウイルスの基本構造となるヌクレオカプシド(ゲノム+カプシド複合体)を覆っていて、宿主の免疫系を回避することを助ける。コロナウイルスのなかまは、このエンベローブを持つウイルス種だ。
⑤E:エンベローブタンパク質(Envelove Protein) エンベローブタンパク質は小さな内在性膜タンパク質で、ウイルスのライフサイクル(アセンブリ、出芽、エンベロープ形成、病原性発現等)のいくつかに関与する。イオンチャネルとしても機能し、他のコロナウイルスタンパク質や宿主細胞タンパク質と相互作用している。このEタンパクを欠損させたウイルスは、感染・成熟・増殖などの能力は著しく低下するという。
2. Sタンパクの構造

SARS-CoV-2のスパイク糖タンパク質 (6VSB spike protein)
※全タンパク質はホモ三量体で、1つのモノマーのみを強調表示しており、残りのトリマーは灰色表示
(青): N末端ドメイン
(マゼンタ)ACE2受容体結合ドメイン(RBD)
(シアン)一般構造
(オレンジ):中央らせん(内側の面)ホモトリマー
(紫):コネクタドメイン
;スパイクタンパク質をウイルスの脂質エンベロープに固定
(黄):ジスルフィド結合
(赤):炭水化物
(灰色):ウイルスの脂質膜
Sタンパク質はⅠ型膜貫通糖タンパク質だ。
ヒトでは全タンパク質のおよそ三割が細胞膜貫通型タンパク質であり、このうち細胞外にN末端、細胞内にC末端を持つ膜タンパク質をⅠ型タンパク質と言う。N末端はアミノ基(-NH2)、C末端はカルボキシル基(-COOH)、タンパク質がmRNAから翻訳されるときはN末端から作られはじめ、C末端で終わる。ウイルスでは細胞膜ではなくエンベローブ膜に、このSタンパクが突き刺さっているわけだ。
コロナウイルスの細胞への侵入は、ウイルスのスパイク糖タンパク質(Spike Glycoprotein)を介して起こる。
Sタンパク質は2つのサブユニット、【S1】と【S2】で構成されている。
コロナウイルスでは、まず(S1)サブユニットが受容体結合ドメイン(RBD:レセプタ-バインディング-ドメイン)を介して宿主細胞受容体に結合する。(S1)は受容体の認識と結合に関与するのだ。続いて(S2)にある融合ペプチド(FP:Fusion Peptido)がホストの標的細胞膜に挿入できるように、スパイク構造の幹である(S2)サブユニットが変化するという流れになっている。
SARS-CoVでは、この<S1+S2>が3つ合わさり、ホモトリマー(同一分子三量体)を構成している。
Sタンパクはつまり、花びら(S1)と軸(S2)が3本合わさったような形をしていて、まず(S1)が宿主細胞に取り付き、その後花びら部分(S1)だけが離れてから、軸部分(S2)が宿主細胞膜と融合するのだ。膜融合に先立って(S1)と(S2)が開裂しなければならないが、その役目(切断)は宿主細胞側に常駐する酵素が担う。このながれは、SARS-CoV-2も同様と思われる。
このほかSタンパクは、大変多くの宿主細胞膜由来の糖鎖をまとっている(従ってスパイク糖タンパク:Glycoproteinという)。SARS-CoV-2のSタンパク遺伝子は、糖鎖付加のためのアミノ酸配列をエンコードしている(翻訳後修飾)。この糖鎖付加(グリコシル化)が、例えば免疫回避など重要な役割を果たしており、Sタンパクの機能に多様性を持たせている(後述)。
3. エンベロープ とEタンパク質
エンベロープは、ウイルスが感染した細胞内で増殖しそこから細胞外に出る際に、細胞膜あるいは核膜などの生体膜を被ったまま出芽することによって獲得される。このため基本的には宿主細胞の脂質二重膜に由来するものである。この脂質とSタンパク/Eタンパク/Mタンパクが結合し、その周りを取り囲んでエンベロープを形成する。
エンベロープタンパク質(E)については、ウイルスが増殖して宿主細胞から出芽する際、ウイルス遺伝子にコードされている膜タンパク質の一部を細胞膜などに発現した後で、膜と一緒にウイルス粒子に取り込み、Eタンパクとして粒子表面に発現させるという。
Eタンパク質は、ウイルスが宿主細胞に吸着する際にそのレセプターに結合したり、免疫などの生体防御機能を回避したりなどさまざまな機能を持つもち、ウイルス感染に重要な役割を果たしている。
一般に細胞膜に由来するエンベロープがあるウイルスでは、Eタンパク質が細胞側レセプターに結合後、ウイルスのエンベロープと細胞膜とが膜融合を起こすことで、エンベロープ内部に包まれていたウイルス遺伝子やタンパク質を細胞内に送り込む仕組みのものが多い。
3.SARS-CoV-2の細胞侵入機構 ー宿主プロテアーゼ依存ー
1. 侵入機構の概要
SARS-CoV-2では、ウイルスSタンパクが受容体結合後に、宿主細胞側酵素の働きで開裂活性化され、エンベローブと細胞膜の融合が起こる。これによりウイルスは、遺伝情報を包んだヌクレオカプシドを細胞質へ送り込むことができる。Sタンパクの開裂は宿主側酵素(プロテアーゼ)に依存するわけだが、ここにはフーリン及びTMPRSS2の2つのプロテアーゼが重要な役割を果たしている。また受容体はSARS-CoV同様にACE2(アンギオテンシン変換酵素Ⅱ)であることがわかっている。
2. 宿主細胞侵入機構の解明研究
■インフルエンザやHIVなどのウイルスの感染、すなわち宿主であるヒト細胞への侵入機構はこれまでに多くの研究成果がある。
国立感染症研究所の竹田誠によれば、ウイルストロピズムの宿主プロテアーゼへの依存性については、センダイウイルス(SeV)研究者の本間らにより1970年代から研究されてきた。
トロピズムとは「親和性、向性」などの意味で、ウイルスの種類によって感染できる動物種、臓器、宿主細胞が決まっていることである。
トロピズムを規定しているものには、まず宿主細胞でのそのウイルスに結合可能な受容体があるかないかだ(レセプター依存的トロピズム)。
しかしこれ以外に、ウイルスの膜融合タンパクと、宿主細胞にある酵素との親和性が大きく影響している(プロテアーゼ依存的トロピズム)。
■■こうした原理の確立における日本人研究者の果たしてきた役割は大きいという。
本間らは1980年代には、ウイルスの活性とそのスパイク糖タンパクの「開裂」に強い相関があることを明らかにした。
そしてプロテアーゼによるS糖タンパク開裂活性化により、宿主細胞膜とウイルスエンベローブの融合が可能になることが結論付けられた。
永井らは、ニューカッスル病ウイルス(NDV)の強毒株と弱毒株の区別と、プロテアーゼによる開裂活性との間にも強い相関があり、
弱毒株のの開裂活性化にはトリプシンが必要なことを明らかにした。逆に強毒株ではウイルス増殖にトリプシンは不要であった。
またNDV強毒株は全身臓器で増殖するが、弱毒株は特定臓器でしか増殖しないことも明らかにされた。
この現象はA型インフルエンザウイルス(IAV)でも同様に観察された。
IAVのエンベローブ上のスパイク糖タンパクであるヘマグルチニン(HA)は、高病原性の鳥インフルエンザの場合、
トリプシン不在でも常に開裂活性化状態で、多段階増殖するのである。
HA遺伝子の解析により、Sタンパクの開裂活性には、開裂部の塩基性アミノ酸配列が単一もしくは不連続(mono-basic)であるか、
複数配列(multi-basic)であるかが影響していて、このことが病原性の強弱を決めていることが分かった。
その後フーリン(furin)などが、multi-basicモチーフを持つ膜融合糖タンパクの開裂活性を行う宿主プロテアーゼであることが判明した。
フーリンはゴルジ体などに普遍的に存在する酵素である。
このことから、multi-basicモチーフを持つウイルス強毒株が、全身臓器で増殖が可能となることが裏付けられた。
しかし、フーリンはmono-basicモチーフをもつウイルスの開裂能を持たない。
以降、複数のプロテアーゼがウイルスの開裂活性化に関与する酵素とされ、これら開裂活性を担う酵素の探求が続けられたが、強毒株でないIAVなどを活性化するヒト呼吸器上皮に発現しているはずのプロテアーゼは、長期にわたり未同定であった。
■■■2003年になり、Gartenらにより気道上皮に発現するⅡ型膜貫通型セリンプロテアーゼ2(TMPRSS2)がIAVスパイクを開裂活性する酵素であることが報告された。奇しくも人々を恐怖させたSARS-CoVが登場した同じ年のことである。
TMPRSS2の生体内でのウイルス増殖に関する役割を明らかにするため、TMPRSS2遺伝子を欠損させたノックアウトマウスでの実験が行われる。
TMPRSS2ノックアウトマウスでは、mono-basic-HAを持つIAVの開裂活性化や増殖は著しく制限されることが明らかになった。
ただ同じIAVでもH3亜型などは、mono-basic-HAを持つにもかかわらず、このTMPRSS2ノックアウトマウスでも増殖してしまう。
H3亜型では、糖鎖の有無やHAタンパクの立体構造上の問題が関与する、との研究もあるが、わかっていないことも多い。
ヒト宿主細胞の他の酵素や、体内細菌の分泌するプロテアーゼが関与しているとの報告もあるようだ。
⇒プロテアーゼ依存性ウイルス病原性発現とTMPRSS2 竹田誠,国立感染症研究所,2019
いずれにしろ呼吸器系ウイルスの細胞侵入の舞台では、プロテアーゼであるTMPRSS2が主役の座に躍り出てきた。
3. ウイルスの膜融合
■ところで、ウイルスが宿主細胞に対して侵入を果たすのと、宿主細胞内で増殖して出ていくのは、まったく別のプロセスと言わねばならない。
そしてSeVやIAVでは、TMPRSS2は宿主細胞内でウイルス粒子が形成される過程でSタンパク開裂を行う一方、侵入してくるウイルスの開裂活性を行うことができない。
ところが、SARSやMERSなどの重症呼吸器症候群コロナウイルスでは、TMPRSS2による開裂活性が観察されるものの、
膜融合Sタンパクの合成や輸送、つまりウイルス粒子形成時にTMPRSS2が利用されることはない。
ウイルスが受容体に結合し細胞へ侵入しようとする過程で、TMPRSS2によるSタンパクの開裂活性化が行われることが明らかにされた。
■■私には同一の宿主プロテアーゼであるTMPRSS2が、同じ呼吸器系ウイルスの中のウイルス種により、全く別のプロセスで働くというのが不思議でならないが、今日、このことはウイルス学の世界では常識となっている。
つまりこういうことだ。
IAVでもSARSでもウイルスが宿主細胞に侵入する際には、スパイクタンパクが受容体に結合してから膜融合する。
しかしIAVなどでは、増殖したウイルスが宿主細胞を飛び出して次の標的となる細胞に結合しようとするときには、このSタンパクは既に開裂しているのである。
一方、SARSなどのSタンパクは最初から開裂しているわけではなく、受容体結合「後」(侵入の瞬間に)にSタンパクの開裂が起こることで、膜融合を可能にしているのである。
■■■インフルエンザウイルス(IVA)はSARS-CoV同様スパイクを持つのに、宿主細胞への侵入時ではなく宿主細胞内でウイルス粒子の合成が行われた後で、Sタンパクの開裂を受ける。これにはどのような利点があるのだろう。これが依然として分からない。
それにIAVなどmono-basicモチーフのウイルスで、一番最初にヒトに感染するものは、どのように宿主細胞に侵入するのか(侵入してくるウイルスを開裂活性化できないのに)。それは、やはり一番最初のウイルスも「開裂済」なのだろう。
そして受容体結合後は、ほぼ全ての真核細胞に備わっているエンドソーム経路で侵入するのだ。エンドサイトーシスである。
インフルエンザウイルスの場合、スパイクタンパクであるHA(ヘマグルチニン)が、もう一つのスパイクであるノイラミニダーゼ(NA)の助けを借りながら宿主細胞の受容体に結合する(宿主細胞側の糖タンパク質のシアル酸残基が受容体となる)。
するとその部分が徐々に内側に陥没し、それを裏打ちするようにクラスリンタンパクが集まってきて取り囲む。
ついにウイルスは受容体に結合したまま、宿主細胞膜とクラスリンにより二重に取り囲まれた形の小胞を形成し、細胞質に取り込まれるのだ。
取り込まれた小胞は直ちにクラスリンを離脱させ、エンドソームに融合する。
以上がエンドサイトーシス機構だ。
一般に初期エンドソームはリソソームなど細胞質の様々な小胞を取り込みながら成熟過程を経てゴルジ体近傍などへ移動する。ただインフルエンザウイルスではコロナウイルス類と異なりマイナス鎖RNA型遺伝子なので、エンドソーム融合後に「遺伝子の脱穀」が行われ、遺伝子は核に到達する。
■■■■このように、ウイルス活性化を担うTMPRSS2など宿主酵素は、それが存在する臓器の細胞部位が限られている(プロテアーゼ局在)。 また、IAVやSeVなどと、コロナウイルス類ではプロテアーゼによる開裂活性化プロセスが大きく異なることもわかった。 そして膜タンパク開裂部位にmono-basic塩基性アミノ酸配列しかないIAVなど低病原性インフルエンザウイルスは、 局在する特定のプロテアーゼに依存的に開裂活性化され増殖する。 ウイルスは増殖可能な臓器の部位が限られる場合が一般的だ。開裂してくれるプロテアーゼがなければ増殖できないのだ。
4. SARS-CoVの膜融合
■SARS-CoVも、エンドソーム内のカテプシンを用いた開裂活性化経路によって細胞侵入可能だ。 しかしTMPRSS2を用いた経路(Sタンパク開裂活性化による膜融合からの細胞侵入)がより優先的に利用されることがわかっている。 このことはエンドソーム内のカテプシンをインヒビターで阻害する実験で、SARS-CoVの細胞侵入に影響がないことからも明らかだ。 そして病原性発現にあたり、SARS-CoVにも宿主側のプロテアーゼへの依存性がある。 TMPRSS2はヒトの気道全域の上皮細胞に発現していて、呼吸器系ウイルスに幅広く使われているのだ。
■■宿主側プロテアーゼは、TMPRSS2のほか、トリプシン(膵液中)、エラスターゼ(好中球が放出)、カテプシン(エンドソーム内)などだ。
2003-SARS-CoVにはフーリン切断サイトが欠損しているため、ウイルス粒子合成時にはSタンパクは未開裂のままその表面にある。
そして宿主プロテアーゼにより開裂を起こして感染するのだ。
プロテアーゼのなかで、トリプシンとエラスターゼは、実験的にウイルス-細胞間の膜融合を誘導できることが確かめられている。
しかしカテプシンはこの膜融合を誘導できない(エンドソーム経路)。
そしてTMPRSS2は非常に効率よくSタンパク開裂活性を行い膜融合を誘導できる。
■■■このように新型ウイルスSARS-CoV-2は、2003-SARS-CoV同様、宿主細胞受容体(後述するACE2)を標的にSタンパクを結合させる。その後、やはり宿主細胞に局在するTMPRSS2によりSタンパクが開裂活性化する。SARS-CoV-2のSタンパクの開裂には、2003-SARS-CoVと異なりFurinも関与する。こうして、開裂によりSタンパクが変性することで膜融合が果されるのである。とりわけACE2とTMPRSS2は、SARS-CoV-2ウイルスの細胞侵入に必須のエレメントであることがもはや明白となった。
5. Sタンパクの2段階構造変化
■受容体結合後のSタンパクには、TMPRSS2などによりどのような構造変化が誘導されるのだろうか?
SARS-CovのSタンパクは二段階の構造変化を誘導される。
国立感染研の松山州徳によれば、SARS-CoVのSタンパクは
<第一段階>
①レセプターに結合すると安定した三量体を形成し、
②Fusion Peptido:FPを露出させ、
③FPが細胞膜に突き刺さる。
<第二段階>
④続いてS2が宿主プロテアーゼによる開裂を受け、
⑤内部のへリックス構造を引き付けることにより、
⑥ウイルスと細胞の膜を引き寄せて融合させる。
という過程をたどる。
このメカニズムは、ウイルスにとって標的細胞で確実に膜融合できる、大変効率の良い仕組みだという。
(「プロテアーゼ依存的なコロナウイルス細胞侵入」松山州徳,国立感染症研究所,2011)
Sタンパクの二段階構造変化
■■SARS-CoV-2も、ほぼ同様のプロセスにより宿主細胞へ侵入を果たす。
ただ、上記④〜⑥の具体的イメージは、一般のわれわれにはなかなか描きにくい。松山による上記論文に、SARS-CoVとよく似たマウス肝炎ウイルス(MHV-2)の「Sタンパクの二段階構造変化」の図解がある。また少しさかのぼるが、鶴留雅人によるウイルス膜融合に関する研究があり、この時点では仮設とされているが、パラミクソウイルスのスパイク構造変化による膜融合誘導の図解がわかりやすいので合わせて参考にされたい。
(「ウイルスによる膜融合」鶴留雅人,三重大,2005)
ウイルスによる膜融合
SARS-CoV-2のSタンパクS2サブユニットには、HR1ドメインとHR2ドメインが存在する。
大まかに言えば、SタンパクのC末端コネクタドメイン(HR2側)がウイルスエンベローブにアンカーされたまま、FP:フージョンペプチド(HR1側)が細胞膜に突き刺さる。HR2ドメインが膜の外面に逆向きに移動することでそのままHR1ーHR2がヘアピン状に折れ曲がっていく。HR1ーHR2は逆向きの束(6-HB:6ヘリックスバンドル )を形成するのだ。これによりエンベローブ/細胞膜双方の膜の曲率が変化し接近した後、ついに膜融合が起こる。このようにトポロジカルに膜融合が完成すると、ウイルスエンベローブの内部と宿主細胞の細胞質も融合する。かくてウイルス遺伝子は細胞質に移動し感染が完了する。
武漢ウイルス研究所らはすでに本年3月には、X線結晶構造解析により、HR1ーHR2:6ヘリックスバンドル (6-HB)コアの構造を決定している。
スパイクのサブユニットS2の構造・・・
しかし、完了段階の6-HBが決定されても、中間工程が実際に上述の通り進行するのか、わかっていない部分も多いようだ。
6. SARS-CoV-2のSタンパクの特異性(SARS-CoVとの比較)
■テキサス大学オースティン校チームは、SARS-CoVと、SARS-CoV-2のSタンパクには類似性があるが、SARS-CoV-2の方が、はるかに人の細胞に取り付きやすいと報告した。D. Wrappらは、SARS-CoV-2のSタンパクの構造を解き、3つの受容体結合ドメイン (RBD)のうちの1つが、受容体にアクセス可能な配座(コンフォメーション)で回転していることを示した。
Science http://doi.org/ D. Wrapp et al.;2020.02.19.
Sタンパクの2段階構造変化のプロセスは、(S1)が受容体に結合したときにトリガーされる。受容体結合は融合前三量体を不安定化させ、その結果(S1)が脱落し、(S2)が安定した融合後コンフォメーションに移行する。
Sタンパクの(S1)ユニットで、受容体結合ドメイン(RBD)は、受容体結合の決定因子を一時的に「隠したり」「露出したり」するヒンジのようなコンフォメーションの動きを受ける。これらの2つの状態は「DOWN」コンフォメーションと「UP」コンフォメーションと呼ばれ、「DOWN」は受容体にアクセスできない状態に対応し、「UP」は受容体にアクセスできる状態に対応するという。
スパイク三量体のうち1つのRBDは「UP」コンフォメーション、他の2つのRBDは「DOWN」コンフォメーションとなった。そしてSARS-CoV-2 Sタンパクのこの形状によって、宿主受容体との結合力が2003-SARS-CoVのそれよりもはるかに強固であることを確認した、ということだ。
■■ 一方アンダーセンらは、RBDタンパク質を構成する6つのアミノ酸残基のうち5つは、SARS-CoV-2とSARS-CoVの間で異なっていることを示した。この配列はACE2への高い親和性をもつとのことだが、計算解析によると必ずしも「最適な」配列ではないという。従ってACE2に対する自然淘汰の結果である可能性が高く、意図的な操作の産物ではないことを示す強い証拠だとも述べている。アメリカからの某国究機関による人為的ウイルス制作説への批判でもあろう。
Nature20200317
■■■グリコシル化
タンパク質は遺伝子でコードされているわけだが、生体タンパク質には糖鎖が結合していることが多い。遺伝子でコードされていない糖鎖が遺伝子でコードされているタンパク質を修飾して、その機能に多様性を持たせているのは不思議なことだが、これも生体内では頻繁に行われている。翻訳後修飾とよばれるタンパク質の成熟化機構だ。

CC BY 4.0 original
図のAは、Sタンパク質プロテオームを構成するタンパク質ドメインの配列を示す。
先述したように、Sタンパク遺伝子は、糖鎖付加のためのアミノ酸配列をエンコードしている。つまり遺伝子は糖鎖を翻訳するわけではないが、タンパク質のアミノ酸配列に糖鎖付加を誘導する暗号を忍ばせているのだ。
糖鎖付加(グリコシル化)は翻訳後修飾(PTM)の1種だが、メチル化やユビキチン化など他のPTMよりもはるかに多様性のあるプロテオームを形成するという。
渡辺・J.D.アレン・D.ラップらはSience;2020.05.04.で、スパイク糖蛋白の糖鎖を分析し構造決定を行っている。
上図Aのタンパク質配列の上下に付加された番号付きの分岐表記が糖鎖だ。
スパイク三量体のそれぞれには、22個の糖鎖が突き刺さっている(下図参照)。これら糖鎖がタンパク質のフォールディングと免疫回避に役立つことを示唆しているという。
 CC BY 4.0 original
CC BY 4.0 original
7. フーリン(Furin)
フーリンは、ヒト細胞にはユビキタスなプロテアーゼ(タンパク質分解酵素)だ。
SARS-CoV-2は、エンベロープに存在するSタンパク質の宿主細胞膜受容体(ACE2)への結合を足がかりに、ヒトの細胞への侵入を開始する。
Sタンパク質は(S1)と(S2)に切断される。その後(S1)が受容体であるACE2受容体に結合する。もう一方の断片(S2)はヒト細胞表面のセリンプロテアーゼであるTMPRSS2で切断されて膜融合が進行する。
S1ーS2切断は、どの酵素が担うのか。
Sタンパク質のゲノム解析により、SARS-CoV-2と2003-SARS-CoVには異なる遺伝子配列のあることが明らかになった。特筆すべきはSARS-CoV-2のSタンパクにはフーリンによるS1-S2切断部位があることだ。このことにより、SタンパクのS1ーS2切断は、Furinにより行われることがわかった。フーリンは宿主細胞側に常駐する酵素だ。これによりSARS-CoV-2のSタンパクは開裂活性化され、感染力と病原性を高めていることが示唆された。
⇒H. Li et al. Preprint at http://chinaxiv.org/abs/202002.00062;2020
アンダーセンらも、SARS-CoV-2のSタンパク質S1ーS2接合部に、フーリンによる切断部位(RRAR)が存在することを明らかにした。この多塩基性の切断部位は、フーリンなどによる効果的な開裂を可能にし、ウイルスの感染性を高め、宿主細胞へのトロピズムの型を広げる役割を持っている。
さらに、"RRAR"の5'末端側にプロリン (P)が挿入され、開裂部位に4アミノ酸"PRRA" (12塩基)が挿入された配列になっている。このプロリンに誘導されるアミノ酸鎖のターンが、開裂サイトの左右側面に3つのO-結合型グリカンを付加するようだ。
多塩基性切断部位と3つの隣接する予測O結合型グリカンはどちらもSARS-CoV-2に固有であり、2003-SARS-CoVにはない塩基配列だ。このことも新型ウイルスの強い感染力を裏付ける、としている。
⇒Nature20200317 The proximal origin of SARS-CoV-2;Nature Medicine(17 March 2020)
8. TMPRSS2(Ⅱ型膜貫通性セリンプロテアーゼ2:transmembrane protease, serine 2)
■SARS-CoVは細胞侵入にあたって、Sタンパクのプロテアーゼ(タンパク質分解酵素)によるプライミングを必要とする。
プロテアーゼは加水分解により、タンパク質のペプチド結合を切断する。
SタンパクはFurinにより(S1)と(S2)に切断された後、(S1)がACE2に結合するのだが、これだけでは膜融合は起こらない。もう一方の(S2)が開裂(第二段階)を受けなければならないのだ。この第二段階の開裂を担うのが、ヒト呼吸器上皮細胞などの表面に発現するセリンプロテアーゼの一種、TMPRSS2(Ⅱ型膜貫通型セリンプロテアーゼ2)である。S2サブユニットはTMPRSS2で切断され、その結果膜融合が進行する。
Hoffmannらにより、SARS-CoV-2の感染には、ACE2とTMPRSS2が気道細胞において必須であることが示された。
⇒SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS230229-4.pdf)
■■TMPRSS2 は、II 型膜貫通型セリンプロテアーゼ(Type II transmembrane serine protease: TTSP)の同族である。
Ⅱ型なので、細胞外にC末端、細胞内にN末端を持つ膜タンパク質だ。
TMPRSS2は492のアミノ酸からなり、N 末端から細胞外に、SRCRドメイン(scavenger receptor cysteine-rich domain)、LDLAドメイン(low-density lipoprotein receptor class A) domain、プロテアーゼドメイン(Serine protease domain)を持つ。
TMPRSS2 は前駆体として合成された後、自身の酵素活性によって活性型となる(自己プロセシング)。開裂部のP3-P1 のアミノ酸配列は「QSR 」になっている。このアミノ酸配列QSRは、多くの呼吸器ウイルスの膜融合タンパクの開裂部に保存されていることが明らかになった 。
⇒プロテアーゼ依存性ウイルス病原性発現機構と TMPRSS2 2019 竹田誠 国立感染症研究所
ただ、《Atlas of Genetics and Cytogenetics in Oncology and Haematology》には、2010年3月のエントリーにTMPRSS2のドメインを詳しく示しているが、上記論文に示す構造とは異なり、N 末端からLDLR-A ⇒ SRCR ⇒ SPDの順としている。
⇒TMPRSS2 Youngwoo Park 2010.03
■■■前述のとおりSタンパクは受容体結合で構造変化を誘導されて初めてプロテアーゼによる開裂活性を受ける。細胞内で増殖し出芽していくウイルスSタンパクはTMPRSS2に切断されず、細胞に入ろうとするウイルスSタンパクが切断される。松山らの実験により、TMPRSS2の空間的方向性がそれらを決定することがわかっている(ウイルスではなく2種類の実験細胞を準備し《一方にSタンパク、他方にACE2を発現させ》、TMPRSS2がどちら側にある時に開裂活性を示すかを確かめている。Sタンパクと相対するレセプター側にTMPRSS2が発現した場合のみ、膜融合が誘導された)。TMPRSS2はウイルスにとって確実に細胞侵入を果たせ、細胞でつくられたウイルスには作用しない、使い勝手の良いプロテアーゼであるということだ。
東大医科学研から本年3月にプレスリリースされた、新型ウイルス侵入プロセスの阻止を強く期待できる既存候補薬「ナファモスタット」も、このTMPRSS2を標的として阻害するものだ。このリリースの冒頭に掲載された、SARS-CoV-2の細胞侵入プロセスを示した図版は大変わかりやすいので、是非参照されたい。
⇒新型コロナウイルス感染初期のウイルス侵入過程を阻止、効率的感染阻害の可能性がある薬剤を同定 井上純一郎ほか 東京大学医科学研究所 2020.03
9. 受容体 ーh-ACE2ー
■ウイルス感染において宿主細胞受容体との相互作用が重要なステップである。細胞侵入に際しウイルスの結合サイトを活性化させる酵素が異なるように、ウイルス種によって結合できる受容体もまた異なるのである。 現在のところ7種が知られるヒトコロナウイルスのうち、MERS-CoVはジペプチジルペプチダーゼ-4受容体(DPP4)と選択的に結合することがわかっている。HCoV-229EウイルスはアミノペプチダーゼN受容体(APN)を標的にしている。HCoV-HKU1およびHCoV-OC43はO-アセチル化シアル酸(O-ac Sia)に結合する。 そしてHCoV-NL63、SARS-CoV、および新型ウイルスであるSARS-CoV-2の3つはみな、ヒトアンジオテンシン変換酵素2受容体(h-ACE2)を利用する。
■■新型ウイルスSARS-CoV-2は、ウイルスの持つ「鍵」であるSタンパクが、宿主細胞側の「鍵穴」の役割を果たすACE2受容体と結合することでヒト呼吸上皮細胞に感染する。 そしてACE2は、ヒト気管支の線毛上皮細胞やII型肺胞上皮細胞に高発現している。 宿主細胞受容体ACE2(アンギオテンシン変換酵素2)とは、どのようなものなのか。
■■■ACE2のサイズ感としては、計算分子量92kDaであるという(N‐グリコシル化のため120kDaに検出される場合あり)。
ウイルス自体のサイズが100〜200nm、またSタンパクの長さ約20nm(分子量180〜200kDa)であり、結合する側からすれば比較的小さく見えるだろう。
ACE2はその名の通り、ACEの同族体だが、役割はそれぞれ異なっている。
そもそも、血圧調節等の循環動態に大きな役割を持つと言われるアンギオテンシンとはなにか。
アンギオテンシンは、肝臓の作り出すタンパク質;アンギオテンシノーゲンを、腎臓が分泌するレニンが分解して作り出される(AngiotensinⅠ:Ang1)。レニンは血液量の減少などに伴い産生される酵素だ。この(Ang1)のC末端2アミノ酸を、肺に存在するアンギオテンシン変換酵素(ACE)が切断することで、アンギオテンシンⅡ(Ang2)が生じる。Ang2がアンギオテンシン受容体:ATRに結合することで血圧が調節される仕組みだ。ATRはGタンパク質共役受容体(GPCR)であり、血圧を上げる1型受容体(AT1R)、及び血圧を下げる2型受容体(AT2R)の2種類があり、協調して(どちらに結合するかで)血圧を調節しているのだ。Ang2はつまりこの協調を制御している生理活性ペプチドだと言える。これら血圧調整に重要な役割を担うレニン−アンギオテンシン系をRAS(renin-angiotensin system)と呼んでいる。アルドステロンも含めRAA系と呼ばれることもあるようだ。
生活習慣病の一つの高血圧症の治療では、当然にこのRAS系の働きを抑えたい。Ang2-AT1R結合を阻害するATR拮抗薬(ARB)、Ang2合成を阻害するACE阻害薬(ACEI:ACEインヒビター)などが、高血圧症治療の分子標的薬として今日普及している。
一方のACE2は、Ang1のC末端から1アミノ酸を切断してAng(1-9)を生成する。あるいはAng2からAng(1-7)を生成する。ACE2により生ずるAng(1-7)は、やはりGタンパク質共役受容体GPRCである「Mas受容体」と結合する。
田野中浩一らによれば、Mas受容体はAT1Rと会合することで、Ang2の作用を減衰させるとの報告がある。さらにAng(1-7)はAT1Rの作用を抑制する方向に働く可能性も示唆された。
Ang2は循環器疾患の憎悪因子であることが知られている。ACE2/Ang(1-7)/Mas-Receptor系は、ACE/Ang2/AT1R系を介する生理活性を抑制、あるいは拮抗する形で機能すると考えられるという。
⇒アンジオテンシン変換酵素2 日本薬理学会 田野中浩一ほか 2016
■■■■ACE2はSARS-CoV-2の細胞侵入のための必須受容体である。
一方で、循環器系にとっては血圧調整面でRAA系に対する抑制を担うなど、ACE2は生体にとってむしろ良い方向で働く酵素でもあった。
皮肉にもSARS感染によりACE2の発現は抑制されるため、RAA系を活性化させてしまい、呼吸器障害を促進させることにつながると考えられている。
SARS-CoV-2のSタンパクが、ACE2結合のための重要なアミノ酸残基を保有していることが明らかになった。この極性アミノ酸残基を介して、SARS-CoV-2はACE2の細胞外ペプチド・ドメインにより認識されるようだ。
そしてSARS-CoV-2のSタンパクのACE2への結合力は,SARS-CoVの少なくとも10倍以上であることが、すでに定量的に明らかにされている。
⇒274 Cell 181, 271-280, 2020年4月16日30262-2.pdf)
■■■■■ACE2は肺のほか、心臓、腎臓、腸、血管など人体の広範囲に発現している。 持病や喫煙などがACE2の数や働きを変化させるという報告がある。 新型ウイルスの感染者に急性腎不全が起こりやすいとも言われ、腎臓に多く発現するACE2との関連が疑われている。 血管にも低濃度ながらACE2が発現することから、腎臓や血管のACE2に新型ウイルスが直接結合し、免疫反応により腎不全や血栓が引き起こされる可能性にも言及されている。 ニコチンに関しても、気道上皮細胞のACE2を増やすとの実験報告もある。 一方、糖尿病や高血圧などの治療薬であるACE阻害薬が、ACE2を増加を誘引する可能性も指摘されている。 ただ、糖尿病患者などはそもそも基礎体力が落ちるなどの影響や、喫煙では気道上皮の粘膜が傷害されることもあり、上記の事象はそのまま因果関係のエビデンスとはならない。
4.ウイルス増殖及び出芽機構

CC BY https://www.flickr.com/photos/niaid/49531042877 NIAID
培養されたヒト細胞から放出されているSARS-CoV2ビリオン
1. 増殖と出芽の概要
SARS-CoV-2はヒトの細胞に感染すると、遺伝子RNAから自己複製のために必要なさまざまなタンパク質を翻訳する。 合成されるタンパク質には、2種類の巨大なポリタンパク質(polyprotein:分子量486kDaおよび790kDa)が含まれている。 ポリプロテインは長い1本のポリペプチド鎖(アミノ酸がペプチド結合でつながったもの)で、この中には、a) さらなるRNAをつくる複製/転写複合体、b) 新たなウイルス粒子を構築する構造タンパク質、そしてc) 2つのプロテアーゼ(ペプチド結合加水分解酵素)がある。 ウイルス自身の持つこの2つのプロテアーゼが、ポリプロテインからこれらすべての機能断片を切り出すのだ。 感染後は、宿主細胞の翻訳装置全体がウイルスタンパク質の生産システムへと転換されてしまう。 こうしてウイルスは複製され、多段階増殖するのだが、この際には、宿主タンパク質であるRNA結合タンパク質・シャペロン・膜再構築タンパク質・脂質合成タンパク質等をも用いてしまう。 さらに出芽に際しては、宿主細胞のタンパク質分泌経路とエネルギーもまた、ウイルス複製のために利用される。 ウイルスはわずか数時間で、1個の細胞に数万個の新しいウイルス粒子(ビリオン)を形成させることができると言われ、その新しいビリオンが、次の健康な細胞に向けて解き放たれる。
2. ウイルスメインプロテアーゼ
■SARS-CoVの場合、ゲノムRNAが宿主細胞の細胞質に放出されると、メインプロテアーゼ(Mainprotease、または3C-like protease)と、パパイン様プロテアーゼ(PLpro)の2つのプロテアーゼによって、2つの長く重複するポリタンパク質、(pp1a)と(pp1ab)に翻訳される。 これらのプロテアーゼの加水分解活性は,ウイルス複製のためのレプリカーゼ複合体の形成に不可欠な複数の機能性タンパク質を生成する。
ウイルスゲノムが翻訳する長い1本のポリペプチド鎖には2つのタンパク質分解酵素が含まれる。プロテアーゼはペプチド結合(-NH-CO-)の切断を通じて、さまざまなタンパク質のN末端やC末端を正しく形成する重要な働きをする。
「今月の分子(2020.2)」には、D.S.Goodsellらによる、SRAS-CoV-2のメインプロテアーゼの構造図が示されている。
⇒今月の分子 Coronavirus Proteases David.D.Goodsell 2020.02.
これによれば、SARS-CoV-2のメインプロテアーゼは、同じサブユニットが2つ集まり2つの活性部位をつくっている二量体だ。ハートのかたちをしている。 トリプシンに近い構造といい、アミノ酸のシステインとその近傍のヒスチジンがタンパク質切断反応を行い、別のドメインがこの二量体を安定化させているという。
■■横山茂之らによれば、SARS-CoVはそのメインプロテアーゼが特殊な基質認識能を持っているという。
ポリプロテインの切断反応に関与するメインプロテアーゼは「3CLプロテアーゼ」と呼ばれる。3CLプロテアーゼはポリタンパク質の一部のため、自己の持つ酵素活性により切り出されることで成熟型となり、活性化される。この作用を「自己プロセシング」と呼ぶ。
「3CLプロテアーゼ」はライノウイルス3Cプロテアーゼとの類似性から3CL(3C like)プロテアーゼと命名された。
ヒトライノウイルスプロテアーゼ(HRV3C:human rhinovirus 3C Proteases)は、特定の配列を認識して切断するシステインプロテアーゼの一種だ。
横山らの研究によれば、「3CLプロテアーゼのC末端側の自己プロセシングにおける特殊な認識様式と認識配列は、自己プロセシングの効率を低下させず、生成される成熟型3CLプロテアーゼのC末端領域の自己阻害活性を抑制するものだ」という。
SARSウイルスの巧みな戦略―プロテアーゼの特殊な基質認識理化学研究所 横山 茂之ほか 2016
要するに、SARS-CoVのメインプロテアーゼは、自己プロセシングにおいても成熟型3CLプロテアーゼの活性化を効率よく図っているのだ。言い換えれば、SARS-CoVはそのようなアミノ酸配列(=ゲノム)を持ったということだ。この自己プロセシング能を、SARS-CoV-2も獲得していると思われる(ただし筆者にはその検証はできていない)。
3. 暗黒期のふるまい
ウイルスは、細菌などの細胞生物のように分裂して増えていくわけではない。ウイルスが細胞に感染(侵入)すると、ウイルスの構成要素は一般にはバラバラになり、ゲノムによるウイルス構成タンパク質の翻訳や、ゲノム自体の複製を経て、子孫ウイルスのすべての構成要素が揃うと集合し、新たなウイルス粒子(ビリオン)となって宿主細胞を出ていく。この間、宿主細胞内ではウイルスは検出されなくなる。この期間を暗黒期と呼んでいる(下記、②〜⑥)。
SARS-CoV-2の侵入から増殖までのステップは、以下のように想定されている。
①スパイクタンパクとヒト細胞受容体ACE2との結合を介して膜融合
②ゲノムRNAをヒト細胞質内へ放出
③プラス鎖ゲノムRNAから相補性のマイナス鎖RNAを複製
④マイナス鎖RNAから数本のサブゲノムRNAsがmRNAへと転写
⑤サブゲノムがそれぞれスパイクなどのウイルス構成タンパク質を翻訳
⑥並行してマイナス鎖ゲノムRNAから、”子孫用”プラス鎖ゲノムRNAの複製も進行
⑦一連のタンパク質とプラス鎖ゲノムRNAが集合し、子孫ウイルス粒子が形成
⑧宿主細胞から放出(出芽)
一本鎖+鎖RNAウイルス((+)ssRNAウイルス)は、ゲノムとメセンジャーRNA(mRNA)の両方として働く遺伝物質を持ち、宿主細胞中で宿主リボソームを用い、直接タンパク質に翻訳される。
(+)ssRNAウイルスのゲノムRNAは、細胞質内でRNAテンプレートとして機能し、RNA依存性RNAポリメラーゼ(RdRp)をコードしている。RdRpの作用によりゲノムRNA相補鎖に複製される。RNA合成は、3'末端へヌクレオシド三リン酸が付加されることで始まり、ヌクレオチジル転移反応を繰り返すことにより相補鎖が伸長していく。
ウイルスタンパクの翻訳は一般に各mRNAの ‘5 末端に存在するオープンリーディングフレーム (ORF) からのみ翻訳される。
ゲノムRNA (mRNA-1) の ‘5 末端約 20kb は、2つのORFからなり、1a と 1b で 802kDa をコードしている。このORF間にはシュードノット (pseudoknot:Pn) と呼ばれる核酸の三次構造が存在する。
(1a)タンパクだけで翻訳が終止する場合と、Pn により 1a + 1b 融合タンパクが合成されるケースがある(1ab)。
(1ab)タンパクは16個の調節タンパクに解裂され、プロテアーゼ(ペプチド結合加水分解酵素)及びRNAポリメラーゼとして働く。
感染後に最初に発現するタンパク質はゲノム複製に関わり、細胞内膜と合わさって(+)ssRNAウイルスゲノムからウイルス複製複合体(VRC)を形成する。VRCはウイルス由来と宿主由来の両方のタンパク質を含み、ミトコンドリア・液胞・ゴルジ体・ペルオキシソーム、また細胞膜やオートファゴソーム等に由来する様々な細胞小器官の膜と結合している。
(+)ssRNAゲノムの複製は二本鎖RNA中間体を介して進行し、多くの場合、複製の際にサブゲノムmRNAも作られる。
リボソームはウイルスゲノムの配列内リボソーム進入部位(IRES)と非常に高い親和性で結合するため、感染後、宿主細胞の翻訳装置全体がウイルスタンパク質の生産へ転換される。
4. 集合と出芽
新たに合成されたウイルス構成タンパク質やゲノムRNAは、宿主細胞膜の内側付近で会合し(アセンブリ)、ウイルスの組み立てが始まる。
細胞膜付近では、宿主細胞の膜タンパク質が排除され、ウイルスEタンパクやMタンパク、Nタンパクが集積していくものと思われる。
これらの集合体は細胞膜から出芽するような形で成長していき、エンベローブで覆われたウイルス粒子となって、細胞外へ放出される。
5.免疫系とウイルスの防御機構
さて、ウイルスを迎え撃つのは免疫系だ。こちらはヒトではB細胞とT細胞が主役となる。
B細胞やT細胞は「リンパ球」とよばれる免疫細胞で、白血球のひとつだ。
■白血球は、造血幹細胞という骨髄にある幹細胞からつくられている。
白血球とは、よく知られているとおり生体防御に関わる免疫担当細胞の総称であり、体内に侵入した細菌・ウイルスなど異物の排除や腫瘍細胞の排除などを役割としている。
白血球はリンパ球を含め以下の3種類からなっており、それぞれに役割がある。
① 顆粒球(好中球・好塩基球・好酸球)・・・白血球全体の6〜7割、感染箇所への遊走による細菌など異物の直接捕食・殺菌を担当
② 単球(マクロファージ・樹状細胞など)・・・白血球全体の5%程度、抗原提示やサイトカイン放出などを担当
③ リンパ球(T細胞・B細胞・NK細胞)・・・白血球全体の3割程度、抗体産生やウイルス感染細胞の攻撃などを担当
※顆粒球の3種類をひとくくりにせず、「白血球は5種類」とする分類が一般的だが、ここでは上記のように整理した。
ヒトの免疫系は、大雑把に言えば2段階で働く仕組みになっている。
・第一段階は「自然免疫系」と呼ばれるもので、上記の①②の免疫細胞が担当する。
・第二段階が「獲得免疫系」と呼ばれるもので、上記③の免疫細胞が担当する。
リンパ球は、末梢血の白血球のうち20〜40%ほどを占める、比較的小さく(6〜15µm)、抗体(免疫グロブリン)などを使ってあらゆる異物に対して攻撃するが、特にウイルスなどの小さな異物や腫瘍細胞に対しては、顆粒球ではなくリンパ球が中心となって対応する。 体液性免疫、抗体産生に携わるのはB細胞とそれをサポートするヘルパーT細胞だ。一方腫瘍細胞やウイルス感染細胞の破壊など、細胞性免疫に携わるのはキラーT細胞やNK細胞である。 リンパ球は骨髄で未熟な状態で産出された後、胸腺(T細胞)や骨髄など(B細胞)で成熟し、さらにはリンパ節に移動し、そこでも増生・成熟が行われるなど、複雑な経過をたどる。
■■SARS-CoV-2のRNAの一部には、宿主細胞に留まるタンパク質も遺伝情報としてコードされている。これらの中には、宿主細胞が攻撃を受けているという信号を免疫系に送信しないようにしたり、宿主細胞の先天性免疫に抵抗するのを助けたりするものが含まれるという。
ヒト免疫システムは、どのようにしてSARS-CoV-2と戦うのだろう。
白血球がウイルスを追跡して感染細胞やウイルスを取り込んで破壊したり、ビリオンを破壊する抗体を産生したりする。抗体産生はその典型だ。
上記の区分で言えば、自然免疫系の樹状細胞などがウイルスを貪食して、その断片タンパク質を免疫細胞表面に露出させ(抗原提示)、その情報を獲得免疫系に伝達することで、免疫グロブリン抗体を産生したり、キラーT細胞を活性化させたりする。
■■■しかし、人によって免疫システムの反応は異なる。インフルエンザと同じように、新型コロナウイルス感染症でも、呼吸器疾患の病歴のない人は軽度の症状だけで済むことが多いが、症状が重くなると予想された人でも軽症で済んだ例や、若くて健康な人でも重度感染症を起こした例も多数ある。呼吸器系の上気道までの感染で済めば比較的軽症で住むのかもしれない。下気道までの感染が広がると、両肺が大きな損傷を受けて呼吸困難など深刻な状態に陥る可能性が高くなる。
こうした一連の状況は、ウイルスと免疫システムの間の、いわば競争だ。最初に感染したウイルス量が少なければ、ウイルスが増殖して制御不能になる前に免疫システムがウイルスによる感染症を克服できる可能性が高いだろう。だが一度重症化したケースでは、免疫システムによる抑え込みが追いつかなくなる。
さらにやっかいなことがある。免疫システムはウイルスの増殖阻止のための情報伝達タンパク質サイトカインを分泌する。サイトカインの過剰産生はサイトカインストームと呼ばれており、これが致命的な過剰炎症反応を引き起こすことがある。免疫システムの暴走だ。
サイトカインは他のサイトカインのさらなる発現を促進(あるいは抑止の場合も)の機能をもつため、サイトカインカスケード(連鎖的反応)を起こす場合があるのだ。
また免疫システムが、SARS-CoV-2の細胞侵入を助け、ウイルス増殖に関与する可能性可能性も指摘されている。
SARS-CoV-2の細胞侵入過程では、タンパク質分解酵素であるエラスターゼもトリプシンやTMPRSS2同様に膜融合を誘導できることが確認されている。エラスターゼは炎症組織で好中球が大量に放出するプロテアーゼであり、重症肺炎時には免疫細胞が作るエラスターゼを利用して細胞に侵入する可能性があるのだ。
このように、我々の体に備わる精緻な免疫系も、必ずしも万全ではないのである。
7.まとめとして
このスタディでは、以下のことが理解されたと思う。
1)今回の新型コロナウイルスーSARS-Cov-2の位置づけや基本構成、また(+)ssRNA型ウイルスとはどのような仕組みを持つのかなど、全般にわたっての基本的な特性が整理され理解された。
2)SARS-CoV-2が、2003-SARS-Covや他のスパイクウイルスに比べ、どのような構造上の特異性があるのかが理解された。
ゲノム全体で見れば、2003-SARS-Covとの相同性は9割近くと、とても近い姉妹種でありながら、ディテールを見れば例えば、Sタンパクの構造で三量体S1ドメインのRBDのコンフォメーション、またRBDタンパク質を構成するアミノ酸残基に違いがあった。これだけの差であっても、宿主細胞への結合性が大きく高められ、結果として2003-SARS-CoVに比しての強毒性を獲得している。フーリン結合サイトの有無という重大な違いも明らかとなった。
3)SARS-CoV-2の細胞侵入のメカニズムが理解された。
SARS-CoV-2及び2003-SARS-CoVは、そのスパイクタンパクがヒトACE2受容体に結合の後に2段階変化を誘導され、宿主細胞に局在するプロテアーゼにより開裂活性化をうけることで初めて細胞侵入できる。このときにSタンパクが具体的にどのような構造変化によって膜融合を実現するのか、またSタンパク構造変化の1段階目はフーリンが、2段階目はTMPRSS2が担っていることもわかった。さらにはSタンパクの開裂がインフルエンザウイルスとは全く異なるタイミングで行われていることも理解できた。
4)細胞侵入後のSARS-CoV-2の増殖と出芽に関する基本的事項を整理できた。 特に、ウイルスメインプロテアーゼが子孫ウイルスの構成に重要な役割を演じており、他のコロナウイルスと比較して巧妙に自己プロセシングの仕組みを獲得してきたこともわかった。
5)SARS-CoV-2と、ヒト免疫系の競合を整理した。
ヒト免疫系は、ウイルス侵入に対して抗体産生するが、個体差により重篤化するケースがある。免疫系も万全ではなく、どのような要素が重症化につながるかなどの展望を試みた。
それにしても、ここまで長い道のりだった。
GW後半の3日ほどと、それ以降の土・日が3週分の、延べ10日以上も本稿に費やしてしまった。
本稿においてウイルスの様々な態様を理解し、整理したと言っても、このスタディはあくまでも概要に過ぎない。本当の具体的・根源的原理にまでは及んでいないのは言うまでもないことである。
このウイルスに関して、多くの研究者が数ヶ月で数千本の論文を書いても、まだまだわからないことが多いのだ。生命科学の世界は深遠だ。
Sタンパクの開裂活性と言っても、実際のプロセス上どのタイミングで開裂の信号を受け渡すのか、ACE2受容体へのSタンパクの結合力が格段に強いと言っても、その強さを担保する分子間の距離とかアミノ酸や各原子の位置取りだとか、それらの間に働く引力の大きさとか、そういった生化学の分野までは、筆者の力では到底踏み込めない。
しかしそれでも、知り得たことも多々あった。
つい我々は、ウイルスの「細胞侵入のための巧みな戦略」とか「免疫系を逃れる巧妙な変異を獲得した」などと、「彼ら」のことを擬人化して表現する。しかし彼らは戦略など持ち合わせていない。そこにはただ、物理現象があるのみだ。そもそもウイルスは生物ですらない。「生命と無生命の間の中間的粒子」というのが、今日の生命科学の代表的なスタンスだ。 このとてつもなく小さな粒子が、アナザーワールドをつくりだした。 生命ではなくとも、新たな変化に向けて彼らは挑戦する。科学者、そして人類も挑戦する。
しばらくは、この厄介なウイルスと人類は付き合っていかなくてはならないようだ。 今後の課題としてもう少し、ウイルス増殖機構や重症化プロセスに関して補足を試みたいと思う。
コロナの稿、了。 2020.05.31.